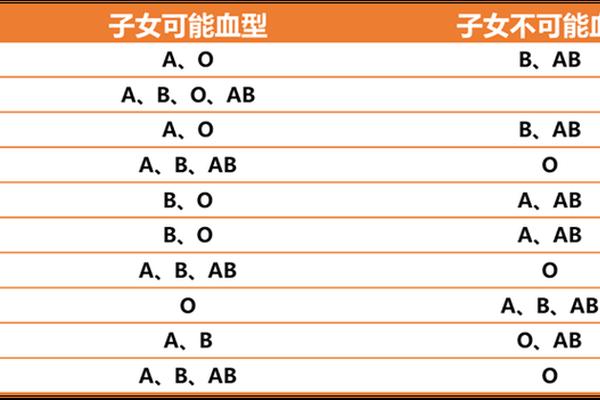
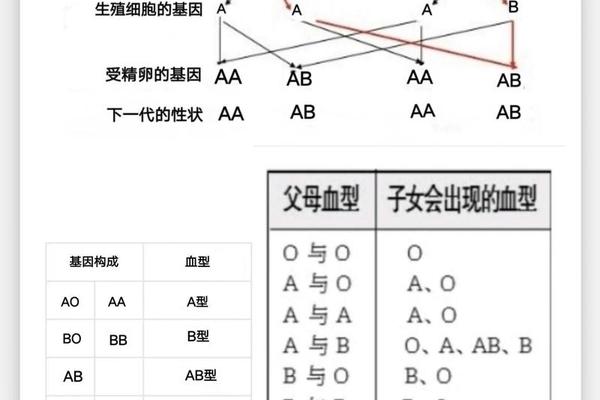
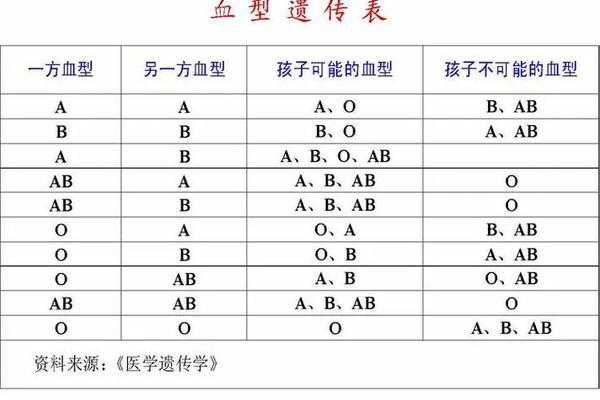
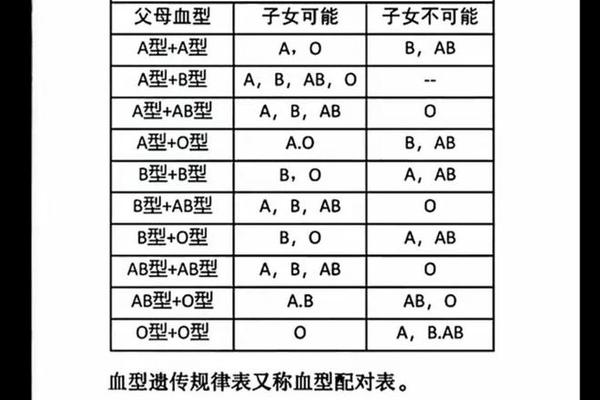
血型A变O 抽血化验O型血变A型血
- 作者:
- 来源: 水镜先生网
- 2025-04-24 13:18:02
在医学史上,血型始终被视为与生俱来的生命密码。随着科学技术的突破,人类不仅实现了通过酶催化将A型血转化为通用型O型血的壮举,更在临床实践中观察到因移植、疾病等因素导致血型检测结果发生“逆转”的现象。这两种看似相反的血型变化模式——主动改造与被动转化——正在重塑人们对血液科学的认知,也为输血安全与精准医疗开辟了全新路径。
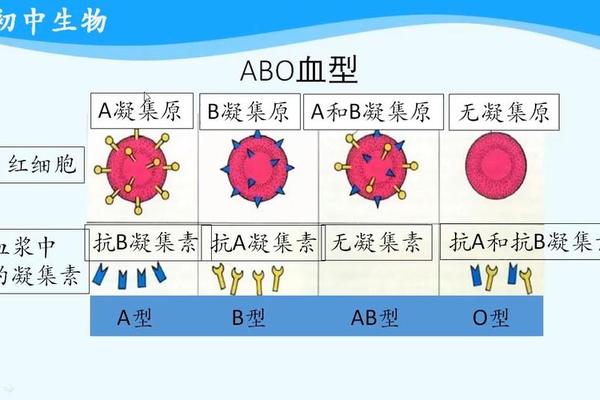
科学基础:抗原与酶的分子博弈
ABO血型系统的核心差异在于红细胞表面抗原的糖链结构。A型血携带的A抗原比O型血多出一个N-乙酰半乳糖胺基团,正是这个仅0.3纳米的分子差异,决定了血液相容性的生死界限。2025年东南大学吴国球团队的研究突破,正是基于对肠道细菌Flavonifractor plautii中两种协同酶的发现:N-乙酰半乳糖胺脱乙酰酶(FpGalNAcDeAc)可精准切断A抗原的乙酰基,半乳糖胺酶(FpGalNase)则进一步分解剩余结构,使A型红细胞在5分钟内完成99%以上的O型转化。这种酶促反应的效率比传统方法提升28倍,冷冻电镜技术更首次揭示了酶活性位点的三维构象。
而被动性血型变化的机制更为复杂。造血干细胞移植后,供体来源的造血系统会全面替代患者原有血细胞,例如O型血受者接受A型供体后,其新生红细胞将呈现A型抗原。某些血液疾病如白血病,则可能通过干扰抗原表达导致血型检测异常——厦门某医院曾发现90岁患者因弱A亚型抗原被误判为O型,经基因检测才确认为罕见Ael亚型。这类现象虽不改变基因本质,却对输血安全构成严峻挑战。
技术突破:从实验室到临床的探索
酶法血型改造技术历经40余年发展,已从早期粗糙提取迈向精准工程化阶段。1982年科学家从咖啡豆提取的α-半乳糖苷酶首次实现B型转O型,但需50磅原料才能处理200毫升血液。2024年丹麦团队在嗜黏蛋白阿克曼菌中发现的新型酶组合,不仅可转化标准A/B型血,对扩展型抗原同样有效,且溶血风险降低70%。东南大学团队进一步通过蛋白质融合技术,将双酶催化效率提升至传统混合酶的28倍,为规模化生产奠定基础。
临床检测领域的革新同样引人注目。传统玻片法依赖肉眼观察凝集反应,易受抗原表达强度干扰。现代分子检测技术通过PCR分析ABO基因型,可识别99.9%的弱亚型与嵌合体血型。2025年某案例显示,造血干细胞移植患者术后4个月血型完全转为供体型,基因检测证实其外周血中供体DNA占比超98%。这类精准监测技术为个性化输血提供了保障。
应用前景与挑战
血型转换技术的临床应用将彻底改变血液供应格局。据估算,全球A型血占比约34%,若将其转化为O型,可使通用血库存量提升2倍以上。但技术瓶颈依然存在:酶处理可能改变红细胞膜特性,导致24小时存活率下降至85%;罕见血型如孟买型的转化仍需突破。争议随之浮现——美国ZymeQuest公司试图将酶技术商业化,却引发“人造血液安全性”的公众质疑。
对于被动性血型变化,医学界已建立严密管理规范。国际输血协会建议造血干细胞移植患者需每3个月进行血型复核,并在病历显著位置标注“嵌合体血型”警示。我国《临床输血技术规范》更明确要求,对放化疗患者需采用分子检测与血清学联合鉴定,避免因抗原减弱导致的误输风险。
未来方向:精准医疗的新纪元
下一代血型改造技术正朝着多功能化发展。加拿大团队尝试用酶法去除肺移植器官的A抗原,使供肺具备O型兼容性,动物实验显示移植存活期延长40%。基因编辑技术CRISPR-Cas9的应用更带来根本性突破——在小鼠模型中,科学家成功敲除ABO基因,培育出永久性O型血个体。这些突破或将推动血型系统从静态分类转向动态调控。
在检测领域,微流控芯片与人工智能的结合正在革新传统流程。某新型设备可在10分钟内完成ABO正反定型、Rh分型及35种稀有血型筛查,准确率达99.98%。区块链技术的引入,则使全球血液信息实现实时共享,2024年欧洲输血联盟通过该技术将错型输血事故降低至0.0007%。
从酶催化到基因编辑,从误判案例到精准监测,血型转换技术正在书写人类掌控生命密码的新篇章。正如《自然》杂志评论所言:“当我们突破ABO系统的桎梏时,不仅解决了血液短缺的难题,更打开了理解生命复杂性的新维度。”未来的研究应聚焦于转化效率提升、长期安全性验证及框架构建,让这项技术真正成为守护生命的利器。