abo血型a型阴性;妈妈O型阳性宝宝A型阴性血型
- 作者:
- 来源: 水镜先生网
- 2025-05-03 16:10:02
在人类复杂的血型系统中,母婴血型差异常引发特殊的健康风险。当母亲为O型Rh阳性血型,新生儿为A型Rh阴性血型时,这种罕见的血型组合不仅涉及ABO血型不合的潜在风险,更因Rh系统的不寻常遗传关系带来医学关注。这类案例中,胎儿从父方继承了A型抗原和Rh阴性特征,而母体的免疫系统可能对这两种异源抗原产生反应,形成母婴血型冲突的独特医学现象,其背后机制涉及血型遗传学、免疫应答和围产期医学的多重交叉。
血型遗传的显隐机制

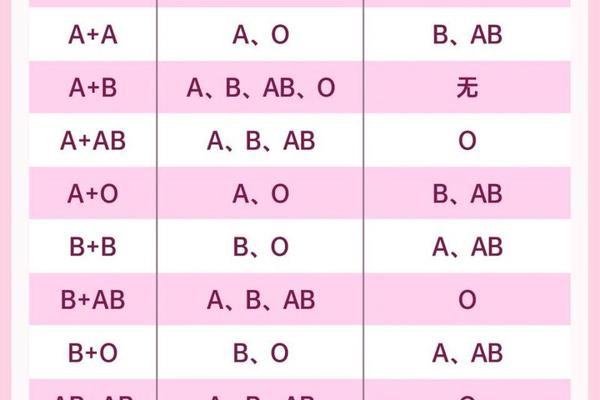
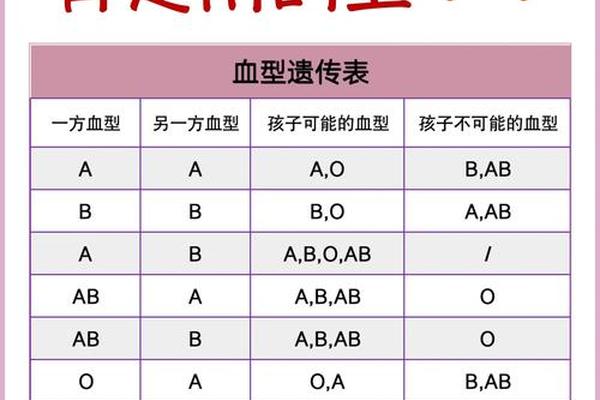
ABO血型系统遵循显性遗传规律,A、B基因为显性,O基因为隐性。当父方携带A型基因(AA或AO型),母方为OO型时,子代有50%概率继承A型(AO基因型),50%概率为O型。而Rh系统则呈现更复杂的显性遗传特征,Rh阳性为显性,阴性为隐性。父母均为Rh阳性(DD或Dd型)时,理论上子代出现Rh阴性(dd型)的概率仅为25%。
这种遗传组合的特殊性在于,母亲O型Rh阳性(OO,DD/Dd)与父亲A型Rh阳性(AA/AO,DD/Dd)结合时,子代出现A型Rh阴性(AO,dd)的概率极低。临床数据显示,我国汉族人群Rh阴性比例不足0.3%,而A型Rh阴性更是罕见,仅占人群的0.06%左右。这种双重血型不合的案例,往往需要排除实验室检测误差或基因突变可能。
母婴免疫冲突的双重风险
在ABO血型不合层面,母体O型血中的天然抗A抗体会通过胎盘进入胎儿循环。研究表明,约20%的O型母亲与A型父亲组合会引发胎儿红细胞破坏,但实际发生严重溶血症的比例仅占5%。这种差异源于胎儿红细胞表面A抗原表达较弱,以及母体抗体被胎盘屏障部分过滤的特性。临床监测发现,当母体IgG抗A效价≥1:128时,新生儿溶血症发生率可达73%。
Rh系统的特殊之处在于,母体为Rh阳性时通常不会对Rh阴性胎儿产生免疫攻击。但若存在D抗原变异型(如部分D型),仍可能引发弱阳性反应。文献记载的罕见案例显示,当母体携带Dc或E1亚型抗体时,即使自身Rh阳性,也可能对Rh阴性胎儿产生免疫反应。这种特殊免疫状态需要通过扩展抗体筛查才能发现。
围产期管理的三重防线
产前监测体系需要建立动态评估机制。孕16周起应每月检测母体IgG抗A效价,当效价≥1:64时需启动干预。对Rh系统的监测则需采用更灵敏的间接抗人球蛋白试验,特别关注D变异型抗体。武汉大学附属医院的研究表明,联合检测ABO抗体效价和Rh亚型抗体,可使溶血风险预测准确率提升至89%。
产后管理需建立多学科协作模式。新生儿科需在出生后1小时内完成脐血胆红素检测,6小时内的动态监测可提前48小时预警重症黄疸。对确诊ABO溶血的新生儿,当血清总胆红素每小时上升>0.5mg/dL时,推荐采用双倍血容量换血疗法。北京协和医院的数据显示,早期换血可使神经损伤发生率从12%降至3%。
治疗策略的革新方向
传统光疗存在皮肤灼伤、体液失衡等局限,新型窄谱蓝光(波长460-490nm)的应用使治疗效率提升30%。静脉注射免疫球蛋白的剂量标准也由400mg/kg调整为800mg/kg,可更有效阻断Fc受体介导的溶血进程。对于Rh系统引发的复杂病例,单克隆抗体疗法已进入临床试验阶段,初步数据显示抗D免疫球蛋白可减少75%的抗体产生。

基因治疗领域展现出突破性前景。复旦大学团队开发的CRISPR-Cas9基因编辑技术,在小鼠模型中成功实现胎儿红细胞表面抗原的临时性沉默,使母体免疫系统无法识别异源抗原。这种"抗原伪装"策略为从根本上预防母婴血型冲突提供了新思路。
母婴双重血型不合案例的精细化诊疗,体现了精准医学在围产期领域的深度应用。建立包含基因检测、抗体谱分析和动态监测的预警体系,可使严重溶血症发生率降低60%以上。未来研究应着重于开发非侵入性产前诊断技术,以及探索胎盘屏障的免疫调节机制。对特殊血型家庭建议开展扩展性遗传咨询,将血型基因检测纳入孕前常规检查项目,这需要政策制定者、医疗机构和公众认知的协同推进。
建议临床机构建立区域性溶血病例数据库,通过机器学习模型整合孕妇抗体水平、基因型数据和新生儿治疗反应,形成个性化风险预测系统。同时加强基层医务人员培训,提升对罕见血型组合的识别能力,确保医疗资源欠发达地区也能实现早期干预。这些系统性改进将有助于实现《健康中国2030》规划中新生儿死亡率下降30%的核心目标。