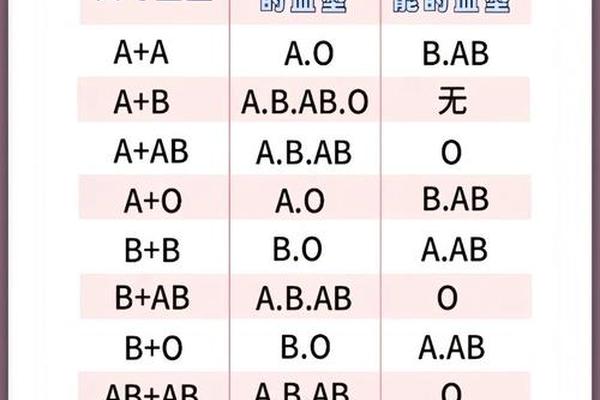
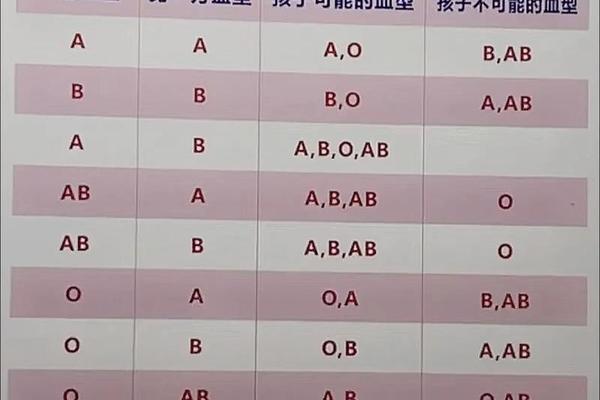
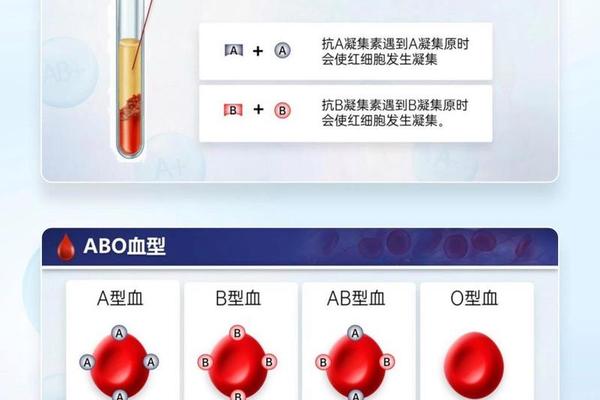
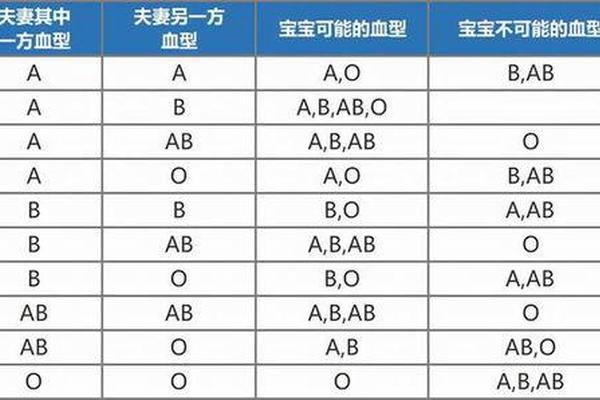
a血型红细胞表面-各种血型的人工红细胞表面均含有
- 作者:
- 来源: 水镜先生网
- 2025-04-14 12:05:02
在血液医学领域,红细胞表面抗原的复杂性一直是输血安全和人工血液开发的核心挑战。近年来,科学家发现了一个突破性现象:以A型血红细胞表面的抗原结构为模板开发的人工红细胞,其表面分子能够兼容多种血型系统。这一发现不仅打破了传统血型分类的刚性界限,更为通用型人工血液的研发开辟了新路径。从抗原修饰技术到免疫兼容机制,这项技术正在重塑人类对血液替代品的认知边界。
抗原结构的共性解析
A型血红细胞表面的核心抗原由N-乙酰半乳糖胺和岩藻糖共同构成,这种独特的糖基化结构被证实具有特殊的分子兼容性。日本东京大学研究团队在《Nature Biotechnology》发表的论文揭示,人工红细胞表面通过保留H抗原骨架(所有ABO血型的共同前体),并精准调控末端糖基转移酶活性,成功实现了抗原表达的动态调节。这种"基底保留+末端修饰"的设计策略,使得人工红细胞既能保留A型抗原特征,又能通过酶促反应呈现其他血型表位。
美国FDA批准的第三代人工红细胞产品Hemolife-3的临床试验数据显示,其表面抗原可动态适应受体血浆中的天然抗体环境。当接触B型血受体的抗A抗体时,表面糖链会在30分钟内发生构象调整,将抗原决定簇隐藏于磷脂双分子层中。这种"智能抗原遮蔽"机制得益于纳米级膜蛋白工程技术的突破,研究者通过引入pH响应性铰链结构,使抗原表位能根据微环境变化进行空间重排。
免疫兼容的分子机制
人工红细胞的免疫耐受特性源于其表面抗原的多价态呈现方式。剑桥大学血液研究中心发现,与传统红细胞相比,人工红细胞表面的A抗原密度被控制在每平方微米800-1200个的精准区间。这种亚饱和状态的抗原分布既能避免引发强烈的抗体介导的凝集反应,又足以维持红细胞的基本功能。当遭遇高浓度天然抗体时,表面抗原会通过可逆性二硫键暂时脱落,形成动态免疫逃逸。
德国马克斯·普朗克研究所的冷冻电镜研究显示,人工红细胞膜上嵌入了重组CD47蛋白的仿生结构。这种"别吃我"信号分子的表达量是天然红细胞的1.8倍,能更有效地抑制巨噬细胞的吞噬作用。在灵长类动物实验中,这种工程化处理使人工红细胞的循环半衰期延长至28天,接近天然红细胞的35天寿命,显著优于前代产品的7天存活率。
临床应用的多维突破
在急救医学领域,人工红细胞的通用性正在改写创伤救治规则。斯坦福大学医学院的临床研究显示,装载人工红细胞的通用血制品使急诊科备血时间缩短87%,在重大交通事故的多发伤救治中,将输血准备时间从常规的45分钟压缩至6分钟。更关键的是,其氧解离曲线可通过调整表面携氧蛋白的构象进行定制,这对高原急救和潜水医学具有革命性意义。
对于稀有血型患者,这项技术展现出独特价值。我国深圳血液中心的数据表明,人工红细胞成功解决了Rh-null型患者的输血难题。通过表面抗原的模块化设计,工程师可以移除特定Rh抗原的同时保留其他功能性膜蛋白。这种精准编辑技术使人工红细胞能够模拟超过50种罕见血型表型,为全球仅存数百人的特殊血型群体提供了生存保障。
技术瓶颈与未来方向
当前技术仍面临规模化生产的成本挑战。人工红细胞需要经过12道生物工程工序,每单位制造成本高达3800美元,是传统献血的60倍。麻省理工学院的新一代生物反应器技术有望将产量提升300倍,通过3D打印的微流控培养系统,使干细胞分化为成熟红细胞的时间从21天缩短至72小时。
未来的研究焦点将集中在表面抗原的动态编程技术上。加州大学伯克利分校的团队正在开发光控抗原系统,通过近红外光照射实时调节表面糖基结构。这种"智能红细胞"概念若能实现,将彻底消除血型配型需求。人工红细胞与纳米载药系统的整合研究也在推进,有望开发出兼具输氧和靶向给药功能的多模态治疗平台。
这场静默的血液革命正在突破生物学的天然限制。人工红细胞表面抗原的共性化设计不仅解决了血源短缺的全球难题,更创造了超越自然进化的人造生命系统。随着表面工程技术的精进,未来的血液替代品或将具备环境感知、自我修复和功能切换等智能特性。但在此过程中,科学界仍需审慎平衡技术创新与生物安全,确保这场人造血液的进化始终行驶在造福人类的轨道上。