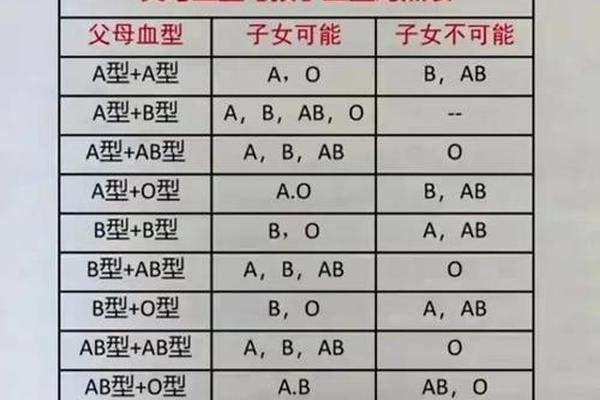
血型A10—a1b型血是什么血型
- 作者:
- 来源: 水镜先生网
- 2025-04-20 18:49:02
在人类血型系统的复杂图谱中,ABO血型的亚型始终是医学研究的焦点。当提及"A10—a1b型血"时,这一命名可能指向ABO血型系统中罕见的A亚型变异体。虽然标准医学文献中尚未明确记载"A10—a1b"的正式分类,但结合ABO亚型的命名规则与基因特征分析,该类型可能属于A抗原表达异常或基因突变导致的特殊亚型。这类血型的发现往往伴随着复杂的血清学反应和基因型特征,对临床输血安全与人类遗传学研究具有双重意义。
一、ABO亚型系统的科学框架
ABO血型系统由Landsteiner于1900年发现,其核心在于红细胞表面A、B抗原的表达差异。在标准分类之外,A抗原存在超过20种亚型,其中A1和A2占据99.9%的比例。亚型的产生源于糖基转移酶基因的突变,这些突变导致抗原表位的结构差异。例如,A2亚型由FUT1基因第547位碱基缺失引起移码突变,使得酶活性降低约80%。
近年基因测序技术揭示,ABO基因位点存在超过300种单核苷酸多态性(SNP),这些变异与亚型形成直接相关。福州地区汉族人群的研究显示,A亚型基因频率分布呈现明显地域特征,A2等位基因占比不足1%。在此背景下,"A10—a1b"可能代表某种新发现的SNP组合,其抗原表达强度介于传统A3与Ax亚型之间。
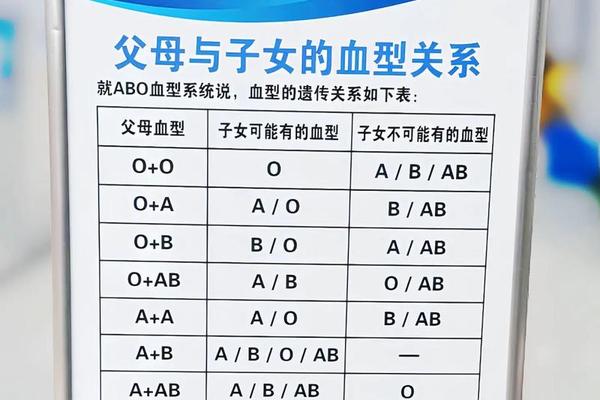
二、血清学特征与鉴定挑战
特殊A亚型的鉴定常遭遇血清学困境。典型A1型红细胞携带A与A1抗原,而弱亚型如A2仅表达A抗原。当遇到Ax或Aend等亚型时,常规抗-A试剂可能仅呈现微弱凝集,甚至出现混合视野现象——即部分细胞凝集而其余保持游离状态。这种特性使得传统血型鉴定可能将A3误判为O型,Ax误判为B型。
某案例研究显示,一例A1B亚型献血者在正定型时出现抗-A1抗体异常反应,通过吸收放散试验最终确认其红细胞同时携带弱化A抗原与正常B抗原。这提示"A10—a1b"型可能需要联合分子诊断技术,如PCR-SSP(序列特异性引物聚合酶链反应)才能准确分型,该方法可检测ABO基因第6、7外显子的关键突变位点。

三、临床输血的风险管理
弱A亚型带来的临床风险具有双重性。对于受血者,误输常规A型血可能引发抗-A1抗体介导的溶血反应,研究显示约26%的A2B型个体血清含有活性抗-A1抗体。而对于供血者,其红细胞若被误分类可能导致O型受血者发生迟发性溶血反应。日本学者山本的实验证实,A3型红细胞抗原密度仅为A1型的1/30,这直接影响了其与抗体的结合能力。
国际输血协会建议,对弱亚型需进行三重验证:血清学定型、唾液血型物质检测和基因分型。我国《临床输血技术规范》特别强调,当正反定型不符时,必须启动扩展试验程序,包括使用单克隆抗-H试剂检测H抗原表达强度,该指标在A亚型鉴别中具有重要价值。
四、遗传进化与种群差异
从分子进化角度观察,ABO基因的多态性可能源于自然选择压力。比较基因组学研究显示,A等位基因在欧亚大陆呈现梯度分布,而非洲人群中B型频率较高。福州汉族人群的ABO基因型分析发现,O等位基因频率高达61.11%,显著高于北方汉族群体。这种差异提示环境因素(如病原体选择压力)可能驱动了ABO基因的区域性演化。
对"A10—a1b"型血的溯源研究需结合群体遗传学方法。通过单倍型分析和系统发育树构建,可以追溯其突变发生的时间节点。欧洲学者发现,A2亚型的共同突变位点出现在约500万年前,与人类与黑猩猩的分化时期吻合。这种古老突变的持续存在,暗示其可能具有某种尚未认知的生物学优势。
五、未来研究方向展望
当前对罕见血型的研究仍存在三大瓶颈:一是标准化命名体系的缺失,不同实验室对同一变异可能采用不同命名;二是临床数据积累不足,多数罕见亚型仅有个案报告;三是基因型-表型关联机制尚未完全阐明。建议建立国际协作网络,采用二代测序技术对献血者进行大规模筛查,同时开发人工智能辅助的血清学图像识别系统。
在精准医疗时代,罕见血型的个体化输血方案亟待完善。通过建立区域性稀有血型库,并开发通用型人工血液替代品,可有效缓解临床用血危机。德国海德堡大学正在研究的酶法改造O型红细胞技术,已实现在实验室条件下将B型红细胞转化为通用型O型细胞,该技术未来或可扩展应用于各类弱亚型。
综观ABO血型系统的研究历程,每个亚型的发现都在改写人类对免疫遗传学的认知。"A10—a1b"型血的存在与否,本质上是对现有血型分类体系的检验。随着单细胞测序和表观遗传学技术的进步,我们有望揭示血型抗原表达的精细调控网络,最终实现输血医学从经验判断向分子诊断的跨越。这种科学探索不仅关乎个别罕见血型的确认,更是推动整个血型系统研究向纵深发展的重要契机。